当前位置:医药财经正文
ctDNA动态监测助力赛沃替尼精准用药
ctDNA动态监测助力赛沃替尼精准用药

导读
MET基因14号外显子跳跃突变 (METex14) 是非小细胞肺癌 (NSCLC) 的新兴生物标志物及治疗靶点,肺腺癌(LUAD)中突变率约为3%,肺肉瘤样癌(PSC)中突变率高达8-32%[1]。PSC是一种少见且预后较差的NSCLC亚型,治疗手段较为局限。
NCT02897479是由上海交通大学附属胸科医院陆舜教授牵头的一项单臂、开放、多中心Ⅱ期临床试验,其中1/3以上的入组患者为PSC。基于这项临床试验结果,国家药品监督管理局(NMPA)已于2021年批准赛沃替尼用于治疗MET基因14号外显子跳跃突变的NSCLC(包括PSC)。
然而,目前关于赛沃替尼基于基因组学的疗效预测生物标志物及耐药机制的研究较少。本研究是NCT02897479的事后分析,旨在通过血浆ctDNA探索基线血浆METex14状态、治疗后清除状态、基线共突变及治疗后获得性突变与治疗疗效及疾病进展的相关性[2]。该研究结果已发表于Therapeutic Advancesin. Medical Oncology(IF=5.485)。
入组人群及样本情况
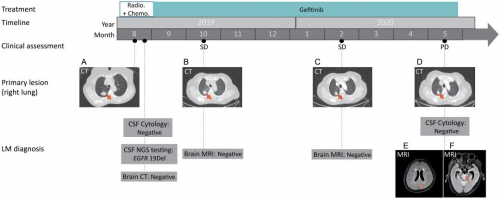
NCT02897479研究共前瞻性入组70例患者,其中66例基线血浆测序的患者被纳入此次事后分析(图1)。46例(70%)患者基线血浆样本中检出METex14,其中24例患者同时送检赛沃替尼治疗6周血浆样本,13名(54%)患者实现治疗后METex14清零。此外,基线血浆样本METex14阴性的患者中也有14例送检了治疗后血浆样本,因此,合计有38例患者送测了至少一次治疗中的血浆样本。疾病进展后,有22名患者送测进展后血浆样本用于赛沃替尼耐药机制探究。

图1. 研究分析路线图
研究结果
基线血浆METex14状态是赛沃替尼治疗PFS和OS的独立预测因素
基线血浆METex14阳性患者与阴性患者相比,肿瘤更大、基线血浆ctDNA含量更高、基于血液的肿瘤突变负荷(bTMB)更高且ECOG体能评分更差。基线血浆METex14阳性组和阴性组客观缓解率(ORR)分别为52.2%和30.0%(p=0.096),无进展生存期(PFS)分别为5.6个月和13.8个月(p=0.108)(图2a),总生存期(OS)分别为10.9个月和未达到(p=0.006)(图2b)。
进一步多因素分析发现,基线血浆METex14状态是PFS和OS独立预测因素。此外,针对不同病理亚型分析发现,PSC患者基线血浆METex14阳性率较其他NSCLC亚型更高(86% vs 61%,p=0.048),但在PSC亚组中,基线血浆METex14状态与患者PFS和OS未见显著差异,可能与样本量相对较小有关。

图2. 基线血浆检出METex14阳性的患者PFS和OS较阴性患者更差
赛沃替尼治疗6周,血浆METex14清零患者预后更好
基线血浆METex14阳性的患者中,有24例送检了治疗后血浆,其中13例患者治疗后METex14清零。METex14清零患者ORR达92.3%,显著高于未清零组的36.4%(p=0.008)(图3a)。中位清零时间在治疗后1.3个月,与首次达到部分缓解(PR)时间基本一致(图3b)。同时,METex14清零组患者具有更长的PFS(11.0个月 vs 5.6个月,p=0.123)和OS(35.8个月 vs 9.5个月,p=0.040)(图4),PSC亚组也有类似趋势。

图3. (a)METex14清零的患者PR率高于未清零患者;(b)METex14首次清零时间与影像学首次PR时间基本一致
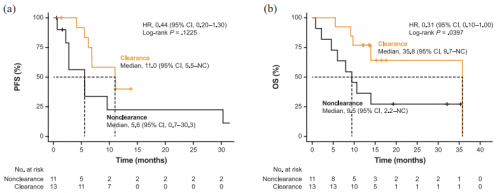
图4. 赛沃替尼治疗6周血浆METex14清零的患者PFS和OS较未清零患者更好
血浆ctDNA动态监测发现新发突变,揭示赛沃替尼耐药机制
基线血浆中最常见的共突变基因为TP53, PSC 患者中突变频率为50.0%,其他NSCLC亚型突变频率为22.7%。基线TP53突变患者与未突变患者ORR、PFS及OS相近,无显著差异。此外,有22名患者送检了疾病进展后血浆样本,其中有10例(45.5%)患者血浆ctDNA检测发现新发基因突变,其中4例出现MET基因突变(D1228H/N和Y1230C/H/S),其余新发突变主要集中在RTK-RAS-PI3K信号通路、转录调控及DNA损伤等信号通路(图5),提示可能与赛沃替尼耐药相关。
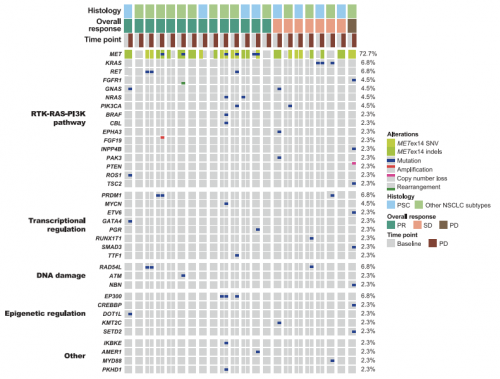
图5. 22例疾病进展患者基线和进展时血浆ctDNA突变对比
结语
本研究通过血浆ctDNA 动态监测结合临床研究疗效数据表明:基线ctDNA METex14阴性及治疗后METex14清零预示着更好的临床疗效,提示血浆ctDNA动态监测是一种预测临床疗效和揭示耐药机制的有力手段。
本研究使用了世和基因泛实体瘤NGS大Panel世和一号检测技术。
参考文献
[1] Salgia R, Sattler M, Scheele J, et al. The promise of selective MET inhibitorsin. non-small cell lung cancer with MET exon 14 skipping. Cancer TreatRev 2020; 87: 102022
[2] Yu Y, Ren Y, Fang J, et al. Circulating tumour DNA biomarkersin. savolitinib-treated patients with non-small cell lung cancer harbouring MET exon 14 skipping alterations: a post hoc analysis of a pivotal phase 2 study[J]. Therapeutic Advancesin. Medical Oncology, 2022, 14: 17588359221133546.